Evaluation interactive du risque autistique en population générale à l’aide de la grille PREAUT
La recherche PREAUT – 2005/2011/2017, par Graciela C. CRESPIN
Présidente de PREAUT.
Cet article présente les résultats de la recherche sur le signe PREAUT, publiés en décembre 2017[1] dans la revue Plos One. Compte-tenu de la nécessité de traiter précocement les Troubles du Spectre Autistique (TSA), un dépistage le plus précoce possible est nécessaire. Cependant, très peu d’outils de dépistage ont été testés prospectivement sur des bébés avant 12 mois.
Cet article montre que 50% des nourrissons positifs à l’un des examens de dépistage ont ensuite reçu un diagnostic neurodéveloppemental.
Les scores à la grille PREAUT, basée sur une évaluation interactive de l’engagement émotionnel, sont significativement associés aux items de risque de TSA moyen et élevé à la CHAT à 24 mois et les résultats de l’étude ont montré que l’utilisation répétée des instruments de dépistage améliore la détection très précoce des TSA et d’autres troubles neurodéveloppementaux.
Le signe PREAUT a déjà montré une excellente capacité à prédire l’évolution vers un TSA chez des bébés à haut risque (souffrant d’un syndrome de West).
Consulter l’article original (en anglais)
Pour votre confort de lecture, seules les introductions et conclusions sont visibles. Il vous est possible de consulter l’intégralité de l’étude en ligne en ouvrant chaque paragraphe, à la demande.
I. Historique de la démarche, Contexte, Critères
Historique de la démarche
Historique de la démarche
En 1998, un groupe de psychiatres, psychologues et psychanalystes, tous praticiens de l’autisme, a fondé l’Association PREAUT, afin de réaliser une recherche visant la validation de signes de troubles de la communication pouvant présager un trouble grave du développement de type autistique.
La recherche PREAUT a été promue par l’Association PREAUT (Paris, France), représentée par son Président, Dr Jean-Louis Sarradet, et par le Programme Hospitalier de Recherche Clinique (PHRC) du CHRU de Strasbourg, représenté par le Pr Claude Bursztejn.
La recherche PREAUT s’est adressée aux pédiatres et médecins de la petite enfance qui reçoivent les bébés dès la naissance pour les visites systématiques du protocole de santé publique français, dans le cadre de la PMI (Protection Maternelle et Infantile). A partir de 1999, Graciela C. Crespin et l’équipe PREAUT ont formé environ 600 médecins dans 12 départements de France métropolitaine et d’outre-mer à l’identification des signes de risque qui faisaient l’objet de la recherche.
Sans privilégier aucune étiologie, l’hypothèse PREAUT postule qu’il doit y avoir, au cours des premiers mois de la vie, des situations psycho-relationnelles qui précèdent la cognition et la rendent possible. Ces situations devraient pouvoir être observées dans la relation entre le bébé et son autre familier (habituellement, ses parents), bien avant que les marqueurs cognitifs habituellement recherchés –le pointage proto-déclaratif et le jeu de faire semblant du CHAT, par exemple – deviennent observables au cours de la deuxième année de la vie.
Le contexte
Le trouble du spectre autistique (TSA) consiste en un groupe hétérogène de troubles neurodéveloppementaux [ 1 ] qui se caractérisent par des perturbations des relations sociales et de la communication, des comportements répétitifs et d’intérêts restreints, avec plusieurs degrés de gravité [ 2 ].
Les études épidémiologiques ont reporté une augmentation récente de la prévalence, mais ces résultats restent controversés. Cette augmentation est probablement attribuable à des facteurs extrinsèques, tels qu’une meilleure sensibilisation à la reconnaissance de la maladie, des modifications dans les pratiques diagnostiques et le développement de services spécialisés [ 3 , 4 ] ainsi que l’élargissement des critères diagnostiques [ 5 , 6 ].
En 2010, la prévalence globale des TSA chez les enfants de huit ans était de 14,7 pour 1 000 aux États-Unis, soit un enfant sur 68 [ 7 ]. En France, l’étude la plus récente, fondée sur le registre des handicaps (MDPH), fait état d’un taux de prévalence des TSA de 35/10 000 chez les enfants du même groupe d’âge [ 8 ].
Il est communément admis que les enfants atteints de TSA doivent être pris en charge le plus précocement possible [ 9 – 14 ]. Les objectifs de ces interventions précoces sont d’améliorer la communication et la socialisation, diminuer les comportements inadaptés, réduire la détresse et améliorer la qualité de vie [ 15 , 16 ].
Certains auteurs soutiennent que le traitement très précoce chez les nourrissons pourrait infléchir la trajectoire développementale déviante, avant l’installation du syndrome autistique complet, voire prévenir l’autisme [ 9 ]. En effet, des études récentes ont tenté d’évaluer la faisabilité, l’efficacité, et les bénéfices d’une intervention très précoce auprès des parents et des nourrissons à risque d’autisme, avec des résultats encourageants [ 17 – 20 ].
Cependant, la mise en place d’un traitement précoce nécessite le développement d’outils permettant le dépistage (ou la détection des enfants à risque) le plus tôt possible [ 21 ].
L’âge minimum pour un diagnostic précoce fiable des TSA pose plusieurs questions scientifiques. Bien que les symptômes de TSA soient souvent présents tôt dans la vie [ 22 – 25 ], le diagnostic de TSA est généralement fait entre trois et cinq ans [ 24 , 26 – 28 ].
Au moins cinq facteurs contribuent à expliquer cette situation :
1) l’inquiétude parentale n’est pas suffisamment prise en compte [ 23 , 29 – 31 ],
2) l’installation d’un TSA se produit parfois après la deuxième année de la vie [ 32 , 33 ],
3) les bébés ont des compétences développementales encore trop immatures pour répondre aux critères de diagnostic,
4) les problèmes de diagnostic différentiel sont complexes à un âge précoce (particulièrement pour les troubles graves du langage et la déficience intellectuelle, DI),
5) le diagnostic est risqué avant l’âge de deux ans parce qu’il est plus susceptible d’être instable [ 34 ].
Les critères de diagnostic des TSA ont changé ces dernières années
Certains auteurs suggèrent que le système de classification actuel et d’autres facteurs peuvent contribuer à l’instabilité croissante de l’attribution du diagnostic de TSA [ 36 ].
Le diagnostic initial pourrait évoluer vers une récupération spontanée ou un retard de développement sans traits autistiques. En effet, la détection précoce ne peut être détachée de toute interférence avec le résultat, car les enfants détectés sont plus susceptibles d’être rapidement pris en charge. Quelques auteurs suggèrent qu’une intervention précoce pourrait diminuer les symptômes autistiques et améliorer le pronostic développemental pour une proportion significative d’enfants, et même faire reculer les processus autistiques secondaires [ 9 ], voire empêcher l’installation d’un TSA [ 17 ].
Le dépistage précoce
Depuis que Baron-Cohen a testé la CHAT (Checklist for Autism in Toddlers) sur des enfants de 18 mois [ 37 ], plusieurs études ont tenté de développer et tester des outils de dépistage, le plus souvent sur des nourrissons à risque (par exemple, des enfants évalués pour suspicion d’autisme, des fratries d’autiste, ou des bébés atteints de maladies génétiques) ou encore sur des enfants qui ont déjà reçu un diagnostic de TSA appuyé sur la clinique et d’autres outils validés, par exemple l’ADI (Autisme Diagnostic Interview), l’ADOS (Autism Diagnostic Observation Schedule) ou la CARS (Childhood Autism Rating Scale).
Ce type d’études doit faire face à plusieurs défis [ 38 ] : les études sur les bébés à risque ont tendance à produire des taux de valeurs prédictives positives (VPP) beaucoup plus élevés que les études de dépistage en population générale, car un taux de prévalence plus élevé implique une probabilité plus grande qu’un résultat positif soit correct [ 39 ].
En revanche, les études en population générale doivent dépister un très grand échantillon pour obtenir suffisamment d’enfants positifs.
De nombreuses études ne permettent pas de connaître la sensibilité et la spécificité de l’outil parce qu’elles n’évaluent que les enfants qui ont été dépistés positifs, ce qui ne permet pas d’identifier les faux négatifs [ 38 ]. Ces études estiment la qualité de l’outil de dépistage à partir de la valeur prédictive positive (VPP) (calculée à partir des faux positifs observés) et évaluent la sensibilité en calculant la différence entre taux de prévalence théorique et taux de prévalence observé.
Mais au-delà de la valeur de l’outil utilisé, le dépistage précoce est confronté au problème de la stabilité incertaine des TSA avant l’âge de deux ans [ 40 ].
Au cours de la deuxième année de vie, les outils de dépistage précoce les plus utilisés comprennent la CHAT [ 41 42 ] ou une version modifiée de la CHAT, notamment la M-CHAT (Modified-CHAT), [ 43 44 ] et la Q-CHAT (Quantitative-CHAT) [ 45 ] ; d’autres outils ont testés avec des résultats variables.[1] La CHAT s’est avérée avoir une bonne spécificité, mais une faible sensibilité [ 52 ] ; la M-CHAT a montré une meilleure sensibilité, mais produit de nombreux faux positifs. Plus récemment, une nouvelle procédure M-CHAT en deux étapes, avec un entretien de suivi, a montré des valeurs métriques potentiellement intéressantes sur un échantillon à faible risque [ 44 ]. Les chercheurs poursuivent actuellement leurs efforts pour dépister l’autisme à un très jeune âge.
Dès l’âge de 12 mois, peu d’outils ont été testés prospectivement. Deux outils ont été testés sur des fratries à risque[2], et trois ont été évalués en population tout-venant[3].
Avant 12 mois, seuls trois outils ont été testés prospectivement et ont montré qu’ils avaient une valeur prédictive : la CSBS-DP DP IT a été utilisée pour dépister en population générale les nourrissons de 6 à 8 mois et de 9 à 11 mois [ 60 ] et la TBCS (Taiwan Birth Cohort Study) a été utilisée pour dépister des nourrissons de 6 mois en population générale [ 61 ]. Ces deux outils ont montré une valeur prédictive positive (VPP) faible.
Le troisième outil est la grille PREAUT (Programme de Recherches et d’Études sur l’Autisme), utilisée pour dépister très tôt des nourrissons à risque, et qui fait l’objet de la présente étude.
[1] Le CESDD (Checklist for Early Signs of Developmental Disorders) [ 46 ] ; le BITSEA (Brief Infant-Toddler Social and Emotional Assessment Questionnaire) [ 47 ] ; le YACHT 18 (Young Autism and other Developemental Disorders Checkup Tool at 18 months) [ 48 ] ; le SACS (Social Attention and Communication Study) [ 49 ] ; l’ESAT (Early Screening of Autistic Traits Questionnaire) [ 50 ] ; et le SCQ (Social Communication Questionnaire) [ 51 ].
[2] L’AOSI (Autism Observation Scale for Infants), échelle d’observation comportementale, s’est montrée capable de prédire l’autisme chez des frères et sœurs à risque entre 12 et 14 mois, mais pas à six ou sept mois d’âge [ 53 , 54 ] et le FYI (First Year Inventory), questionnaire destiné aux parents, a montré des résultats encourageants à 12 mois [ 55 ].
[3] Le FYI a été utilisé dans une étude sur la population générale avec un petit échantillon [ 56 , 57 ], le SACS est un inventaire comportemental qui a rapporté des résultats remarquables dans une étude de dépistage à 12 mois en population générale [ 49 ], mais qui n’ont pas été confirmés par des recherches ultérieures, et la CSBS-DP IT-Checklist (Communication and Symbolic Behaviour Scales -Developmental Profile Infant-Toddler Checklist) est un questionnaire pour les parents qui a démontré une grande spécificité, mais une sensibilité et VPP faibles [ 58, 59 ].
De l’observation du comportement du nourrisson à l’observation des interactions
Plusieurs auteurs ont proposé un changement de paradigme, dans un mouvement de l’évaluation du comportement du nourrisson vers l’évaluation dyadique des interactions, car les retards dans les étapes de développement ou les difficultés dans les interactions sociales précoces ne sont pas suffisantes pour prédire un TSA. Ils soutiennent que le dépistage précoce des TSA devrait s’appuyer sur les interactions dyadiques, plutôt que sur le comportement des nourrissons. La perspective des cascades développementales suggère que le dysfonctionnement d’un système peut influencer un autre système au fil du temps et ainsi organiser une trajectoire développementale déviante [ 62 ]. Des études récentes sur les TSA, utilisant une approche rétrospective à travers des films familiaux [ 25 , 63 – 65 ] ou une approche prospective sur des échantillons à risque (p. ex., fratries [ 66 – 69 ]), plaident en faveur de ce changement par l’étude de la qualité des interactions précoces (à travers la synchronie, la réciprocité et l’engagement émotionnel) [ 70 ].
En effet, les mères de nourrissons à risque tentent de compenser le manque d’interactivité de leur enfant en intensifiant la stimulation dans les échanges dès le début de la vie [ 65 ]. Green a proposé l’idée que les spécificités interactives des nourrissons à risque d’autisme peuvent modifier les comportements parentaux dans des boucles interactives [ 71 ]. G.C. Crespin propose la même idée dans son concept des « états de sidération » [1].
C’est pourquoi il semblait utile de développer un outil centré sur les capacités spontanées du nourrisson à susciter des interactions à la fois comportementales et émotionnelles avec son partenaire privilégié [ 70 ], plutôt que de se concentrer sur quelques comportements isolés ou des compétences générales de l’enfant.
La grille PREAUT a été développée à cet effet et a été testée à l’âge de neuf mois sur des nourrissons diagnostiqués syndrome de West et donc à haut risque de TSA [ 72 ].
Les bébés dépistés positifs se sont avérés avoir un risque de développer un TSA ou une DI à l’âge de quatre ans, égal à 38 fois celui des bébés négatifs. L’outil a ainsi montré une excellente valeur prédictive positive (VPP), mais seulement sur un petit échantillon de nourrissons avec syndrome de West [ 72 ]. Les résultats sur des échantillons d’enfants à risque élevé ne peuvent pas être directement généralisés sur la population générale (à faible risque) [ 73 ].
Ainsi, dans la présente étude, nous avons évalué la capacité de la grille PREAUT à prédire le risque de TSA au cours de la première année de la vie dans la population générale.
Nous avons examiné les bébés à 4, 9 et 24 mois, car ils sont systématiquement examinés à ces trois âges dans le suivi pédiatrique de routine en France.
Le but était de mettre en place une procédure de dépistage le plus précoce possible, réalisable dans le cadre du suivi médical habituel des nourrissons, ouvrant la voie à des soins préventifs précoces pour les enfants identifiés à risque.
La M-CHAT révisée avec Follow-up (MCHAT-R FU) n’étant pas encore validée lorsque notre étude a commencé, nous avons utilisé, pour le dépistage à 24 mois, la CHAT, qui était le meilleur outil validé à ce moment-là.
Nous avons fait l’hypothèse que :
1) un dépistage positif précoce à la grille PREAUT prédirait un dépistage positif ultérieurement à la CHAT ;
2) un dépistage positif précoce à la grille PREAUT prédirait un TSA entre trois et quatre ans, et
3) l’utilisation répétée de plusieurs outils améliorerait la sensibilité et la spécificité du processus de dépistage.
[1] G.C. Crespin, « Les états de sidération », in Traitements des TSA : à la recherche d’un modèle français, pp. 51-67, Erès, 2013
II. Méthode, Outils, Déroulement
Concept de l’étude et participants
Dans cette étude prospective et multicentrique, les nourrissons ont été recrutés dans les centres de PMI (Protection Maternelle et Infantile) de 10 départements de France métropolitaine et d’Outre-mer entre Septembre 2005 et Novembre 2011.
Une étude pilote a été menée avant 2005 pour évaluer la faisabilité de former de nombreux médecins à coter et à utiliser dans leur pratique habituelle les outils de dépistage PREAUT et CHAT.
Les nourrissons sont systématiquement examinés à 4, 9 et 24 mois dans le suivi pédiatrique de santé en France.
Le service de PMI (santé publique) a été conçu pour permettre à toutes les familles, y compris celles de milieux défavorisés, d’accéder à une prévention et des soins médicaux gratuits. Aucune donnée sociodémographique n’a été collectée.
Le seul critère d’inclusion était d’être un enfant suivi par un service PMI, et les critères d’exclusion étaient le non-consentement des parents aux évaluations de suivi et/ou au protocole de recherche. Les parents ont donné un consentement éclairé verbal après avoir reçu des informations verbales et écrites sur l’étude par le médecin assurant l’inclusion de l’enfant.
Le Comité de Protection des Personnes de l’Hôpital de Saint Germain en Laye a donné son autorisation au déroulement de l’étude le 14 Décembre 2000. Nous avons examiné 12 179 bébés avec la grille PREAUT à quatre mois (PREAUT-4) et / ou à neuf mois (PREAUT-9). Sur ce total, 4 835 enfants ont pu être examinés avec la CHAT à 24 mois (CHAT-24).
Outils de dépistage : La grille PREAUT
La grille PREAUT a été développée à partir de l’observation de films familiaux de bébés plus tard diagnostiqués autistes, et du matériel clinique fourni par le travail thérapeutique auprès des nourrissons à risque [ 74 ].
Laznik a émis l’hypothèse que les bébés qui risquent de développer un TSA pourraient présenter un déficit du besoin inné d’échanger et d’être une source de plaisir pour la personne avec laquelle ils interagissent, contrairement aux nourrissons en bonne santé [ 70 ].
La grille PREAUT évalue la capacité du nourrisson à s’engager spontanément et de manière synchrone dans des interactions ludiques et jubilatoires [ 72 ].
Les items de la grille PREAUT (par exemple : le bébé regarde-t-il l’examinateur / sa mère (ou son substitut) – spontanément, ou seulement s’il est sollicité ?) ont été formulés afin de cibler le manque d’initiative sociale : en effet, plus un bébé est spontanément et activement engagé dans l’interaction, meilleur est son score PREAUT.
La grille est cotée par le médecin lors de la visite habituelle du nourrisson avec sa mère (ou son substitut). Le médecin observe comment le bébé se comporte avec lui et avec sa mère, non seulement quand il est sollicité mais aussi quand personne ne le sollicite directement.
La grille est fournie dans le tableau S1. Elle comprend une première partie de quatre items et une deuxième partie de six items complémentaires. La deuxième partie n’est complétée que si le nourrisson a montré des comportements à risque aux quatre premiers items (score à la première partie
Dans une étude exploratoire en population générale, nous avons constaté qu’à 9 mois très peu de nourrissons atteignaient ce seuil (seulement trois nourrissons positifs, dont 1 cas de TSA). Ainsi, à 9 mois, nous avons décidé de relever le seuil à
Outil de dépistage : La CHAT (Checklist for Autism in Toddlers)
L’échelle CHAT est un instrument de dépistage du risque d’autisme chez des enfants de 18 à 24 mois évaluant leurs comportements habituels et modalités de jeu.
Elle comprend neuf questions proposées aux parents (items A), évaluant l’intérêt de l’enfant pour les interactions sociales, les jeux moteurs, le jeu de faire semblant, le pointage, le fait d’apporter un objet pour le montrer (recherche d’attention conjointe), et cinq questions d’observation évaluant le comportement de l’enfant et les réactions aux stimuli initiés par l’examinateur (items B: échange de regards, jeu de faire semblant, pointage proto-déclaratif, compréhension du pointage et construction d’une tour de cubes) [ 41 , 52 , 75 ].
Les nourrissons sont considérés comme étant à risque élevé quand ils échouent aux cinq items-cibles. Les nourrissons sont considérés comme « positifs » avec un risque moyen, lorsqu’ils ne pointent jamais (pointage proto-déclaratif), ni selon leur mère (A7) et ni lors de l’observation par l’examinateur (B4) [ 37 ].
Nous avons retenu le seuil du niveau de risque moyen pour avoir une meilleure sensibilité. La CHAT a été administrée à l’âge de 24 mois pour coïncider avec le calendrier d’examens systématiques du suivi pédiatrique en France.
Déroulement de l’étude Première étape de l’étude : la formation des équipes médicales
La première étape de l’étude a consisté à former aux outils de dépistage six cents pédiatres et médecins généralistes travaillant dans les services de Protection Maternelle et Infantile (PMI) de dix départements métropolitains et d’outre-mer[1].
La formation de trois journées comprenait une actualisation de connaissances générales sur l’autisme, la présentation des objectifs et de la méthodologie de l’étude, ainsi que les outils de dépistage utilisés. Les praticiens ont participé à des jeux de rôle dans des petits groupes pour apprendre à utiliser les instruments. Des sessions de cotation sur support vidéo ont été réalisées afin de les entraîner et évaluer leur capacité à utiliser les outils.
[1] Certains départements dont les médecins avaient été formés n’ont finalement pas participé à l’étude.
Deuxième étape de l’étude : l’inclusion de l’échantillon de bébés
La deuxième étape visait à inclure au moins 10 000 bébés afin d’atteindre une puissance statistique suffisante compte-tenu d’un taux de perdus de vue de 50% au fil des deux années du protocole de dépistage. Le diagram-flow est présenté ci-dessous :
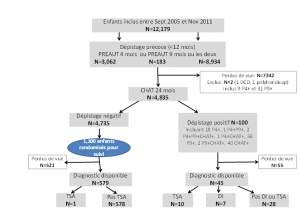
Au cours de la première année de déroulement du protocole, 12 179 nourrissons ont été examinés avec la grille PREAUT à quatre et/ou à neuf mois, dont 8 933 ont pu être examinés aux deux âges.
Sur les enfants restants, 3 062 nourrissons ont été examinés à quatre mois seulement et 183 à neuf mois seulement, en raison de données manquantes ou des visites annulées.
Sur les 12 179 bébés examinés avec la grille PREAUT pendant la première année, seuls 4 835 enfants ont passé la CHAT à 24 mois, ce qui indique que 7 342 enfants ont été perdus de vue au cours du suivi avant la visite des deux ans. Deux bébés ont été exclus en raison d’un décès prématuré et d’un polyhandicap.
Il n’y avait pas de différence significative entre les nourrissons qui ont eu le dépistage avec la CHAT et ceux perdus de vue lors de l’évaluation à 24 mois, pour le sexe ou l’âge à la première évaluation PREAUT[1]. En revanche, il y avait une différence significative dans les scores de la grille PREAUT pour les enfants ayant obtenu un résultat positif à la première évaluation de la grille PREAUT, et qui avaient bénéficié d’un suivi précoce.
[1] Pour les chiffrages, se référer à l’étude originale chez PLOS ONE – Version française sous presse.
Troisième étape de l’étude : examen de sortie de protocole et recherche de faux négatifs
La troisième étape consistait à :
1) l’évaluation diagnostique entre trois et quatre ans pour les enfants ayant été positifs à l’un des examens de dépistage, moyennant l’application d’un examen de sortie de protocole,
2) l’estimation des faux négatifs.
L’examen de sortie de protocole
Un rendez-vous de suivi a été proposé aux 100 enfants ayant eu un score positif (à la grille PREAUT à 4 ou 9 mois et/ou à la CHAT à 24 mois). Les étapes du développement étaient systématiquement tracées lors des visites pédiatriques obligatoires, incluant les paramètres périnataux (grossesse, accouchement, terme, poids de naissance, Apgar) ainsi que les antécédents médicaux (pour l’enfant et la famille).
Les médecins de PMI ont assuré un examen pédiatrique pendant la troisième ou la quatrième année de l’enfant, au cours de laquelle un psychologue qualifié a administré la CARS (Childhood Autism Rating Scale) et la WPPSI (Wechsler Preschool and Primary Scale of Intelligence) ou le test de Brunet-Lézine. Le cas échéant, le psychologue évaluait cliniquement les symptômes de TSA pour établir un diagnostic clinique positif selon les critères de la CIM-10[1].
En plus de ce rendez-vous de suivi, les enfants positifs à n’importe quelle étape du dépistage ont été immédiatement orientés vers des services de soins spécialisés, qui ont fourni ultérieurement une évaluation clinique contribuant au diagnostic final.
En général, les recommandations françaises pour l’autisme rendent obligatoire l’utilisation d’un instrument standardisé, comme par exemple l’ADOS (Autism Diagnosis Observation Schedule) ou l’ADI (Autism Diagnostic Interview) [ 76 ]. Cependant, compte-tenu de la taille de l’échantillon, ces évaluations n’ont pas été effectuées par l’équipe de recherche mais plutôt par des services de soins spécialisés proches du domicile de la famille.
Si le diagnostic de TSA restait discutable, un pédopsychiatre de l’équipe de recherche a rassemblé des informations supplémentaires auprès des services de suivi et de la MDPH pour savoir si l’enfant bénéficiait d’aménagements scolaires particuliers.
Au total, 45 enfants (45%) ont reçu une estimation diagnostique à la fin de l’étude.
Des 17 enfants qui ont reçu un diagnostic de TSA ou de DI, 15 ont été suivis par des professionnels des services spécialisés qui ont fourni un diagnostic et/ou décrit des symptômes compatibles avec le diagnostic de TSA ou de DI ; pour les deux autres cas, les parents ont refusé des consultations spécialisées, mais le praticien de PMI et le psychologue scolaire (en se basant sur l’observation comportementale et des tests psychométriques) ont fourni une description des symptômes concordants avec un TSA (dans un cas) et de DI (dans l’autre cas). Au total, tous les diagnostics sont basés sur des symptômes cliniques en accord avec les critères de la CIM-10.
En ce qui concerne les tests et évaluations complémentaires des 7 cas de TSA détectés par le dépistage PREAUT, 2 ont été évalués avec des outils de diagnostic de référence dans un centre spécialisé, 4 ont eu une évaluation plus large pour explorer les TSA et les DI (CARS, WIPPSI, WISC, IRM, EEG, test génétique) et 1 a reçu seulement un diagnostic clinique CIM-10.
Pour les 6 cas de TSA détectés par la CHAT à 24 mois, 2 ont été évalués dans un centre spécialisé, 3 ont eu une évaluation plus large pour explorer un TSA et une DI, 1 avait seulement un diagnostic clinique.
Six enfants ont reçu un diagnostic « autre ». Les informations justifiant ces diagnostics provenaient de services spécialisés pour trois, de bilans de maternelle pour deux et du psychologue scolaire pour le dernier cas.
Pour les 22 enfants n’ayant reçu aucun diagnostic (enfants en bonne santé), la plupart avaient simplement une évaluation clinique (avec ou sans tests) émanant des informations données par l’école qu’ils fréquentaient indiquant que l’enfant se développait bien.
Il n’y a pas eu de différences significatives entre les enfants qui ont reçu un diagnostic estimé et ceux qui ont été perdus de vue par rapport au sexe ou à l’âge à la première évaluation de la grille PREAUT, ou le pourcentage d’enfants à risque après le dépistage par la CHAT.
En revanche, il y avait une différence significative dans les scores de la grille PREAUT, tels que les enfants positifs à la grille PREAUT avaient un meilleur taux de suivi que ceux qui n’avaient pas été dépistés positifs au cours de la première année.
Recherche des faux-négatifs
Nous avons tiré au sort 1 100 enfants parmi ceux négatifs à tous les instruments de dépistage afin d’évaluer leur évolution et identifier d’éventuels troubles neurodéveloppementaux (recherche de faux négatifs).
Les médecins de PMI participant à la recherche ont recueilli des informations concernant ces enfants à quatre ou cinq ans lors d’examens systématiques effectués à l’école (bilans de maternelle) ou dans le cadre d’un suivi. La plupart ont bénéficié d’un « bilan de maternelle », incluant des aspects généraux de leur intégration à l’école et des aspects plus spécifiques de leur développement, tels que la motricité globale, image du corps, motricité fine, organisation de la perception, langage expressif et compréhension.
Si le diagnostic était discutable, un pédopsychiatre de l’équipe de recherche a obtenu des informations supplémentaires auprès des services de suivi en lien avec la MDPH.
Les enfants étaient considérés perdus de vue lorsque leurs informations étaient incomplètes. Au total, 579 enfants (52,6%) avaient une estimation diagnostique à la fin de l’étude.
Parmi les 1 100 enfants sélectionnés au hasard et ayant des résultats négatifs à tous les outils de dépistage, il n’y avait pas de différences significatives entre ceux qui ont reçu un diagnostic estimé et ceux qui ont été perdus de vue, sur le sexe, l’âge à la première évaluation PREAUT, ni au score PREAUT.
[1] CIM 10 : Classification Internationale des Maladies, 10è édition.
III. Analyses statistiques, Résultats
Analyses statistiques
Toutes les analyses statistiques ont été réalisées avec le logiciel R, version 2.12.2. Le seuil de significativité α a été fixé à 0,05 et tous les tests statistiques étaient bilatéraux. Les variables qualitatives ont été analysées avec le chi-carré ou le test exact de Fisher et les variables quantitatives avec le test t de Student. Les odds ratios et des intervalles de confiance à 95% ont été calculés. Les VPP ont été calculées sur les données actuelles, ce qui nous a permis de répondre à la question : « Compte-tenu d’un résultat positif à un des examens de dépistage, quelle est la nouvelle probabilité de TSA ? »
Pour accéder au détail de l’ensemble des calculs effectués sur les données de l’étude, vous êtes invité à vous référer à l’article publié en décembre 2017 chez Plos One[1].
[1] Infant and dyadic assessment in early community-based screening for autism spectrum disorder with the PREAUT grid. Olliac B, Crespin G, Laznik M-C, Cherif Idrissi El Ganouni O, Sarradet J-L, BaubyC, et al. (2017) Infant and dyadic assessment in early community-based screening for autism spectrum disorderwith the PREAUT grid. PLoS ONE 12(12): e0188831.https://doi.org/10.1371/journal. pone.0188831
Résultats
Dans l’ensemble, 4 835 enfants (2 385 filles (49%), 2 450 garçons (51%)) ont été évalués avec la grille PREAUT à quatre et/ou neuf mois et la CHAT à 24 mois.
Cent bébés étaient positifs à au moins un examen et six étaient positifs à deux ou trois.
Nous avons examiné les associations significatives entre un score positif à la grille PREAUT et chaque item de la CHAT[1]
À l’âge de quatre mois, la grille PREAUT (seuil = 3) prédit de manière significative l’échec à plusieurs items de la CHAT à 24 mois : A5, B2, B3, B4.
De plus, à neuf mois, la grille PREAUT (seuil = 5) prédit de manière significative l’échec aux items A7 (pointage protodéclaratif) et B2 (attention conjointe) de la CHAT.
Or A5, A7, B2, B3 et B4 sont les cinq items-cibles de la CHAT.
De plus, un score positif à quatre ou neuf mois à la grille PREAUT prédit un score de risque à la CHAT à 24 mois[2] avec une forte probabilité.
[1] En utilisant la valeur ajustée de p de Holm-Bonferroni, en raison des analyses multiples.
[2] Avec des odds-ratio de 12,3 à 78,0, tous p < 0,001.
Valeurs prédictives positives
Les enfants qui étaient positifs à l’un des outils de dépistage (PREAUT-4, PREAUT-9, ou CHAT-24) ont été évalués systématiquement afin d’identifier des troubles du développement (TD), y compris une DI ou un TSA.
Sur les 100 enfants dépistés positifs à la première étape, 45 ont été suivis et ont reçu une estimation diagnostique ; parmi ceux-ci, 22 étaient en bonne santé, 10 ont reçu un diagnostic de TSA, sept un diagnostic de DI et six un autre TD [trouble spécifique de la parole et du langage (N = 2), retard de développement global (N = 2), trouble déficitaire de l’attention avec hyperactivité (TDAH, N = 1), et trouble mixte des conduites et des émotions (N = 1)].
Le devenir et les caractéristiques cliniques (pour les TSA et/ou les DI) des bébés positifs à un ou plusieurs examens de dépistage figurent dans les Tableaux A et B du Tableau S2 dans l’article original[1].
Il y avait 4 filles et 13 garçons. Les cas montrent une grande hétérogénéité. Il est intéressant de constater que toutes les filles étaient positives précocement au dépistage et ont reçu un diagnostic de DI, comorbide ou non avec un TSA. Deux d’entre elles avaient un facteur génétique causal identifié.
Concernant le timing du dépistage de nouveaux cas, parmi ceux dont le diagnostic a été confirmé lors du suivi, 10 enfants (5 avec TSA et 5 avec DI) étaient positifs dès 4 mois, 3 enfants supplémentaires (2 avec TSA et 1 avec DI) étaient positifs à 9 mois, et 4 nouveaux enfants (3 avec TSA et 1 avec DI) n’étaient positifs qu’à 24 mois, ce qui conduit à un total de 17 sujets atteints de TSA ou DI.
Pour les valeurs prédictives positives (VPP) estimées, pour les TSA seulement et pour les troubles neurodéveloppementaux (TSA ou DI [déficience intellectuelle]) voir le Tableau 2 de l’article original.[2]
[1] Article paru en 12.2017 chez Plos One.
[2] Les détails sur les estimations pour l’échantillon total de 4 835 enfants sont fournis dans le Tableau S3 (pout TSA seulement) et dans le Tableau S4 (pour TSA et DI agrégés). Pour PREAUT-4, la VPP moyenne était de 25,9% pour les TSA et 52,2% pour les troubles neurodéveloppementaux (DI + TSA). Pour PREAUT-9, la VPP moyenne était de 28,3% pour les TSA et 39,2% pour les troubles neurodéveloppementaux (DI + TSA). Pour CHAT-24, la PPV était de 26.6% pour les TSA et de 32,7% pour les troubles neurodéveloppementaux (DI + TSA). Voir l’article original de Plos One.
Sensibilité, spécificité et valeur prédictive négative (VPN)
Nous avons d’abord calculé les faux négatifs et les vrais positifs[1] pour calculer la sensibilité et la spécificité.
Nous avons tiré au sort un échantillon de 1 100 enfants négatifs au dépistage pour déterminer leur devenir et rechercher les cas de faux négatifs.
Sur les 1 100 enfants, cinq n’ayant pas passé la CHAT ont été exclus, et 516 étaient perdus de vue pour le suivi (soit ils ne se sont pas rendus à l’évaluation du médecin de PMI, soit l’ont refusée, soit ont déménagé).
Parmi les 579 autres enfants, une fille a été diagnostiquée TSA. Sur les 578 autres enfants sans TSA, 52 ont reçu un diagnostic d’autres troubles selon l’estimation du pédiatre (retard de langage, retard du développement global ou troubles du comportement)[2].
Pour le calcul du nombre de vrais positifs et les stratégies utilisées, voir Tableau S3 de l’article original.
Les valeurs prédictives négatives (VPN), la sensibilité et la spécificité de chaque outil et des outils combinés, pour les TSA seuls et pour les TSA + DI ont été calculées[3].
Toutes les spécificités et VPN étaient au-dessus de 98%.
La sensibilité moyenne pour P4 est d’environ 18%, de 36% à P9 et de 38% à C24.
Le fait de répéter le dépistage à quatre et neuf mois avec la grille PREAUT (sensibilité cumulée P4 + P9) a permis de détecter la moitié des enfants qui recevront ultérieurement un diagnostic confirmé de TSA.
En outre, la combinaison des trois outils augmente considérablement la sensibilité, dont la moyenne a atteint 73% pour la détection des cas de TSA.
Nous avons effectué la même analyse pour estimer la sensibilité et la spécificité de chaque outil à détecter les troubles neurodéveloppementaux (combinaison des TSA et des DI). La sensibilité estimée pour chaque outil varie de 26 à 36%, mais la sensibilité moyenne si les évaluations sont répétées atteint 81%. Encore une fois, toutes les spécificités et VPN étaient au-dessus de 98%.
[1] Voir tableaux S3 et S4 dans l’article original.
[2] Sur les 4 735 cas négatifs à tous les examens de dépistage (PREAUT-4, PREAUT-9 et CHAT-24), nous avons extrapolé le nombre de faux négatifs du sous-échantillon randomisé de 1 100 enfants. Puisque sur les 579 cas négatifs à tous les examens de dépistage qui ont pu être suivis, nous avons constaté un diagnostic de TSA (1 faux négatif), nous avons extrapolé huit faux négatifs pour les 4 735 cas négatifs.
[3] Voir tableau 2 de l’article original.
Effet du sexe
Des études récentes ont montré un effet d’interaction du sexe avec le dépistage précoce [ 77 ]. Nous avons donc utilisé des modèles binomiaux mixtes linéaires (LMMs) pour déterminer si le sexe influençait directement ou indirectement les prédictions du dépistage précoce. Dans chaque modèle, nous avons testé si un diagnostic final de TSA peut être prédit par un résultat de dépistage positif spécifique (P4, P9 ou C24), par le sexe, ou par l’interaction entre un outil de dépistage spécifique et le sexe. Nous n’avons pas pu observer d’effet significatif du sexe sur la prédiction diagnostique.
Discussion: Résumé des résultats
Le but de cette étude était d’examiner la capacité de la grille PREAUT à détecter un risque de TSA à un stade de développement très précoce en population générale.
Nous avons recruté prospectivement plus de 12 000 enfants, et plus de 4 000 ont été suivis jusqu’à 24 mois.
Le devenir des enfants positifs et d’un échantillon randomisé d’enfants négatifs a été évalué à l’âge de trois à quatre ans.
La valeur prédictive positive (VPP) a pu être calculée directement, mais une extrapolation a été nécessaire pour estimer la sensibilité et la spécificité, en raison des enfants perdus de vue (voir les limites de l’étude).
La grille PREAUT a été capable d’identifier un risque précoce d’autisme et autres troubles neurodéveloppementaux dans ce vaste échantillon.
Les résultats à la grille PREAUT à quatre ou neuf mois étaient significativement associés aux résultats de la CHAT à 24 mois.
La sensibilité et la VPP pour les deux outils de dépistage étaient à peu près similaires (sensibilité d’environ 30%, VPP d’environ 25%), même si le dépistage avec la grille PREAUT a été effectuée 15 à 20 mois plus tôt qu’avec la CHAT.
Il est à noter que l’utilisation répétée des instruments de dépistage et/ou leur association a augmenté leur sensibilité en la portant au-dessus de 70%. Ainsi, 2/3 des cas de TSA ont été détectés à 24 mois.
La répétition du dépistage PREAUT à quatre et à neuf mois a permis de détecter la moitié des cas de TSA dès l’âge de 9 mois.
Nous avions déjà montré la capacité de la grille PREAUT à prédire les cas de TSA dès la première année de vie, dans une étude antérieure sur des nourrissons à haut risque avec syndrome de West [ 72 ].
Dans la présente étude, la grille PREAUT a été en mesure de prédire correctement un diagnostic de TSA dans une proportion notable (un vrai TSA sur quatre bébés positifs), alors qu’elle était utilisée en population générale, dans laquelle la prévalence des TSA est relativement faible [ 78 ]. De plus, de nombreux enfants « faux positifs » ont en fait reçu un autre diagnostic de trouble du développement, la DI étant le plus fréquent.
Ainsi, le taux de vrai positif passe à un sur deux pour dépister un trouble neurodéveloppemental global (TSA + DI), car la moitié des nourrissons dépistés positifs à l’âge de quatre mois ont plus tard reçu un diagnostic de DI ou TSA.
Ces résultats neurodéveloppementaux pourraient justifier une intervention très précoce.
Dans leur étude, Jones et Johnson, faisant valoir qu’il existe une variabilité importante des trajectoires de développement précoce, ont proposé que l’intervention précoce devrait cibler « les mécanismes neurodéveloppementaux qui produisent des symptômes cliniques au cours du développement précoce », sans attendre le diagnostic clinique. Cela pourrait « à long terme améliorer ou même prévenir l’apparition des symptômes » [ 79 ].
Enfin, la grille PREAUT a démontré son utilité dans les mains des professionnels formés dans les services pédiatriques de prévention et d’accueil et d’accompagnement de la petite enfance. Ainsi, cet outil peut être utile pour élaborer des stratégies de détection précoce des TSA ou d’autres troubles neurodéveloppementaux, et mettre en place des soins les plus précoces possibles, ce qui est crucial pour le pronostic.
Les bébés positifs à la grille PREAUT devraient être examinés avec soin et être pris en charge pour favoriser au maximum le développement de leurs capacités interactives.
D’autres études le montrent
Ces dernières années, plusieurs auteurs ont tenté d’évaluer les avantages d’une intervention très précoce sur des bébés à risque d’autisme (voir la revue de la littérature faite par Bradshaw, et coll., 2015 [ 19 ]).
Par exemple, un essai randomisé en aveugle auprès de bébés âgés de 7 à 10 mois à risque d’autisme a suggéré que 6 à 12 séances d’intervention à domicile avec les parents permettait d’augmenter l’attention du nourrisson aux parents, de réduire les marqueurs comportementaux de risque autistique et d’améliorer le désengagement de l’attention [ 18 ].
Une autre étude a suggéré qu’une dizaine d’interventions précoces à domicile incluant les parents avait « le potentiel d’impacter les systèmes cérébraux qui sous-tendent l’attention sociale chez les bébés à risque familial de TSA » [ 20 ].
Ces dernières études ont été menées avec les frères et sœurs non symptomatiques, dont le risque pour l’autisme est estimé jusqu’à 20%.
Dans notre étude, des enfants positifs à P4 ou P9 avaient un risque d’autisme supérieur à 20%. Il semble donc raisonnable de proposer une détection très précoce suivie d’une intervention pour les bébés à risque.
De plus, il est possible que l’intervention précoce, dont le but est d’intensifier la sensibilité des parents aux signaux émis par le nourrisson, puisse être en mesure de prévenir ou du moins atténuer, non seulement la symptomatologie des TSA, mais aussi d’autres troubles neurodéveloppementaux que nous avons trouvé associés à un résultat positif à la grille PREAUT.
Comparaisons avec d’autres outils et études
Compte-tenu du nombre d’études sur le dépistage de TSA, nous avons limité notre comparaison aux études prospectives, qui ont évalué des instruments de dépistage au cours des deux premières années de vie, et sur un échantillon de la population générale. Les résultats des recherches menées en population générale (avec VPP, sensibilité et spécificité si disponibles) sont résumés dans le tableau 3 de l’article original.
Les outils de dépistage les plus étudiés dans la deuxième année de vie sont la CHAT et la
M-CHAT. Dans notre étude la VPP de la CHAT est plus faible (27%) que précédemment rapporté [ 52 ], alors que sensibilité et spécificité sont à peu près similaires. Cela peut s’expliquer par le fait que, dans notre protocole, le test n’était passé qu’une fois, pour accroître sa sensibilité et ainsi favoriser la faisabilité de notre étude[1].
Par ailleurs, il était raisonnable d’attendre une meilleure VPP de la CHAT dans notre étude sur des enfants de 24 mois que celle rapportée par Baird et al. chez des enfants de 18 mois (avec également une seule administration).
La M-CHAT aurait pu avoir une meilleure sensibilité que la CHAT [ 43 , 44 ], mais elle n’était pas encore validée en 2005 lorsque nous avons commencé notre étude.
En tout état de cause, le dépistage combiné grille PREAUT dans la première année + M-CHAT à 18 ou 24 mois devrait être plus sensible que le dépistage combiné PREAUT + CHAT, donc cette association est à considérer pour les programmes de dépistage systématique en population générale.
D’autres outils de dépistage testés prospectivement, en population générale, sur des enfants de 12 mois ou moins[2], ont montré des faibles VPP.
La sensibilité et la spécificité de la grille PREAUT (qui ne sont pas toujours disponibles pour d’autres outils de dépistage, voir le tableau 3 de l’article original) étaient tout à fait comparables à celles d’autres outils, alors qu’elle a été administrée plus tôt. Sa spécificité était supérieure à 98%, et sa sensibilité, quand l’examen était répété à quatre et à neuf mois, était supérieure à 50%.
Le fait d’adjoindre la CHAT à 24 mois à la grille PREAUT à quatre et neuf mois a permis d’atteindre une sensibilité totale de 73%.
Ce résultat confirme que la mise en œuvre des programmes de dépistage précoce, à l’aide d’une démarche en deux étapes pourrait être cliniquement pertinente et conduire à une détection plus précoce des TSA [ 80 ].
[1] En effet, dans l’étude originale de la CHAT, la VPP était de 59% lorsqu’elle était administrée une deuxième fois chez les positifs, mais de seulement 8% lorsqu’elle n’était administrée qu’une seule fois ; en revanche une administration unique produisait une meilleure sensibilité (celle-ci augmentant de 21 à 35%) [ 52 ].
[2] Le FYI [ 56 , 57 ], le SACS [ 49 ], le CSBS-DP IT [ 58 , 59 ], et le TBCS [ 61 ].
Implications pour le dépistage précoce des TSA
Nos résultats suggèrent le développement d’une nouvelle stratégie de dépistage et de diagnostic des enfants à risque de troubles neurodéveloppementaux.
Premièrement, nous pensons qu’un dépistage précoce devrait, au mieux, détecter un risque de développer des troubles du neurodéveloppement, dont les TSA.
Les tests de dépistage devraient être proposés largement à un âge précoce. Ils ne doivent pas fournir un diagnostic définitif, mais indiquer la possibilité d’un trouble du développement qu’il est peut-être trop tôt pour identifier.
Il est donc nécessaire de suivre les enfants jusqu’à l’âge trois ou quatre ans avec une évaluation détaillée pour confirmer ou exclure le diagnostic initial [ 48 ].
Cependant, l’identification de signes d’alerte précoce des troubles neurodéveloppementaux devrait conduire à une évaluation spécialisée des interactions du bébé et pourrait justifier des soins d’accompagnement sans attendre le diagnostic final.
Deuxièmement, nos résultats et ceux d’autres études suggèrent qu’une approche dyadique des interactions tenant compte à la fois de la synchronie et des émotions pourrait être utile pour évaluer précocement le risque de TSA dans la première année de vie, et met en lumière l’importance de considérer simultanément les deux dimensions plutôt que de les considérer comme s’excluant mutuellement [ 65 , 81 , 82 ]. Les parents peuvent être d’excellents informateurs des processus pathologiques qui se produisent chez leur enfant en développement [ 22 , 23 , 29 , 30 , 83 ].
Troisièmement, nos résultats confortent l’idée qu’un dépistage répété pourrait représenter la meilleure stratégie pour augmenter la sensibilité, dont la valeur est souvent la plus faible dans le domaine du diagnostic précoce des TSA.
Les instruments doivent être adaptés aux capacités développementales et les outils de la première année et ne devraient pas être les mêmes que ceux de la deuxième année.
Durant la première année, les instruments avec une évaluation dyadique pourraient avoir une valeur ajoutée.
Limites de l’étude
Notre étude a cependant plusieurs limites.
Tout d’abord, elle a été affectée par une perte considérable de l’échantillon de départ. Nous avons perdu environ la moitié des enfants à chaque étape de l’étude.
Des 12 179 enfants inclus dans le protocole et dépistés avec la grille PREAUT, 4835 ont participé à la consultation de 24 mois et passé la CHAT. Parmi eux, seuls les 100 cas positifs ont été sollicités pour évaluer leur évolution, dont seulement 45 ont pu être effectivement suivis. Ainsi, les VPP ont été calculées sur une partie seulement de l’échantillon positif.
Le fait que les centres de PMI reçoivent un nombre important de familles appartenant aux catégories socio-professionnelles défavorisées, souvent de diverses origines culturelles, peu ou pas francophones, a peut-être contribué au nombre élevé de familles perdues de vue au fil du protocole.
Malgré cela, il est important de mettre en œuvre des actions de recherche dans des conditions de terrain visant à élaborer des stratégies de dépistage qui puissent toucher des populations qui ont peu accès à des soins privés.
Nous ne pouvons pas exclure un biais possible ou une différence aléatoire entre les échantillons suivis et perdus. Cependant, il y eu peu d’enfants perdus (moins de 14%) parmi ceux qui étaient positifs à la grille PREAUT à quatre mois et qui ont eu la CHAT. Ainsi, la VPP de la grille PREAUT à quatre mois (P4) est solide.
En revanche, en raison d’un taux élevé de perdus de vue, la VPP de la grille PREAUT à neuf mois (P9) et le CHAT à 24 mois (C24) sont une estimation basée sur l’hypothèse que l’échantillon perdu était comparable à celui qui a pu être suivi.
L’estimation de la sensibilité et spécificité requiert d’identifier les faux négatifs. Nous avons suivi un échantillon aléatoire d’enfants négatifs et supposé que l’échantillon d’enfants négatifs perdus de vue était semblable à celui qui a été effectivement suivi.
Deux facteurs sont en faveur de cette hypothèse :
1) la comparaison entre les données des enfants suivis et celles des enfants perdus de vue ne montre pas de différence significative en âge ou sexe, et
2) la prévalence des TSA (0,56 à 0,74%) sur la base de ces estimations est concordante avec la prévalence attendue (0,67%) d’après les études épidémiologiques [ 76 ].
Une autre limite est que les TSA n’ont pas toujours été évalués à l’aide d’outils de diagnostic « gold standard », comme l’ADI-R [ 84 ] ou l’ou ADOS [ 85 ]).
Nous n’avons pas toujours pu organiser des évaluations directes en raison de la grande dispersion géographique de notre échantillon – plus de 10 départements français métropolitains et d’outre-mer participaient à l’étude.
Cependant, l’utilisation d’informations émanant d’équipes de soins psychiatriques ou parfois des psychologues scolaires, a fourni une description suffisamment détaillée des symptômes de l’enfant et de ces éventuelles déficiences fonctionnelles, ce qui a permis d’établir un diagnostic en adéquation avec les critères de la CIM-10.
En revanche, cette étude portant sur l’autisme, les faux négatifs ont généralement été moins bien évalués pour la DI, et la possibilité d’un diagnostic final de DI parmi les négatifs a été insuffisamment investiguée.
Troisièmement, nous n’avons pas pu évaluer l’effet des interventions précoces sur les résultats des enfants, car cela n’a pas été systématiquement tracé.
Cependant, du point de vue des « cascades développementales » [ 62 ], il est probable que le suivi et l’accompagnement cliniques à cet âge précoce aient pu influencer les trajectoires développementales des enfants.
Enfin, le test de dépistage à 24 mois était la CHAT, connue pour être moins sensible que la M-CHAT, mais celle-ci n’était pas encore validée au moment où notre étude a commencé.
D’autres études devraient répliquer et confirmer ces résultats, en population générale ou sur d’autres populations à risque (comme les fratries), en utilisant la M-CHAT à 18 ou 24 mois. Elles devraient également mieux suivre l’effet potentiel des interventions sur le devenir et proposer des outils d’évaluation plus standardisés, tels que l’ADI-R et l’ADOS.
L’importance des enfants perdus de vue au fil du suivi pourrait aussi être diminuée si les registres des MDPH étaient disponibles en France pour la recherche, comme cela se pratique dans d’autres pays. A l’heure actuelle, ces registres sont disponibles dans seulement deux départements en France [ 78 ].
Conclusion
Le but de cette étude était d’examiner la validité de la grille PREAUT comme outil de dépistage des bébés à risque de TSA en population générale. La VPP observée, ainsi que la sensibilité et la spécificité estimées permettent d’envisager l’utilisation de la grille PREAUT pour le dépistage très précoce des TSA et d’autres troubles du développement en population générale, rendant possible l’identification des nourrissons et familles requérant un soutien précoce, afin de réduire l’impact de l’installation d’un TSA ou d’une DI. La répétition du dépistage avec des outils d’approches différentes, a permis une augmentation significative de la sensibilité du dépistage tout en maintenant les VPP, VPN, et spécificité.
Nos résultats indiquent également que l’évaluation interactive (synchronie et émotion) peut aider à détecter le risque de TSA à un stade très précoce du développement de l’enfant.
Les acteurs de santé sont essentiels pour détecter des problèmes développementaux au plus tôt, y compris les TSA, au cours d’un suivi régulier du développement, de façon à permettre aux enfants d’accéder plus tôt à des interventions précoces et adaptées.
Remerciements
Les auteurs remercient vivement les enfants et leurs familles ayant accepté de participer à l’étude.
Contributions d’auteur
Conceptualisation : Marie-Christine Laznik, Claude Bursztejn, David Cohen
Collecte de données : Graciela Crespin, Jean-Louis Sarradet, Colette Bauby, Anne-Marie Dandres, Jean Xavier, Nicolas Bodeau
Analyse formelle : Bertrand Olliac, Nicolas Bodeau
Obtention de fonds : Graciela Crespin, Jean-Louis Sarradet, Claude Bursztejn
Enquête : Graciela Crespin, Colette Bauby, Anne-Marie Dandres, Emeline Ruiz, Jean
Xavier, Catherine Saint-Georges
Méthodologie: Claude Bursztejn, David Cohen, Catherine Saint-Georges
Administration du projet : Graciela Crespin, Jean-Louis Sarradet, David Cohen, Catherine
Saint-Georges
Ressources : Graciela Crespin, Jean Xavier
Logiciel : Oussama Cherif El Idrissi Ganouni
Supervision : Graciela Crespin, Bruno Falissard, David Cohen
Rédaction – projet original : Bertrand Olliac, Catherine Saint-Georges
Rédaction – Révision et édition : David Cohen, Catherine Saint-Georges.
Version française (sous presse) : Graciela C. Crespin, révisée par Catherine Saint-Georges.
